年別アーカイブ: 2016年
ISO22716内部監査員トレーニングセミナー フォローアップ
2016-10-19 セミナー関連
10月19日に実施いたしました、ISO22716内部監査員力量トレーニング講座のフォローアップ資料を回覧します。
当日は遠方からもご参加頂き、誠にありがとうございました。
本来は2 daysオンサイト(お客様側)にて実施している内容ではありますが、ご要望に合わせ基本要素を切り出した講座でございました。

自己宣言又はプライベート認証によりISO 22716の適合を進めていくためには、「内部監査の機会」が大変重要になる事をご説明いたしました。規格をベースとした通り一遍のチェックシートでは、実際の運用問題点の抽出や被監査者側への気付きを与えるために不十分な場合が出てまいります。「マネジメントシステム自体を監査する」とのアプローチを忘れずに、当日の気付き等を活かして頂けましたら幸いです。
ケーススタディStep Down Questionの事例に付きまして
回答例のスライドをアップして置きます。このケースは、問題に対して説明を求めるのではなく、エンドポイントを決定したうえで簡単な回答(今回はYes or No)の質問を数回繰り返し、その回答を共有することで被監査者側に問題点の気付きを与えることが狙いになっています。(基礎-2で深く学ぶ「ロジカルシンキング」の思考がベースです)

ISO 9001:2015年度版とISO 22716:2007版の相関に付きまして
9001と22716の両方のシステム構築を進めている企業様では、相関を取ることに難儀されているお話をよく伺います。これらのアプローチには「各項目ごとを完全リンクさせていく」と考えるのではなく、自社で運用している現状のシステムに対して「新版9001の概念」を「22716にどのように適応していくか」を考え、エッセンスを当てはめて行くアプローチが重要です。このためには両規格の理解が必要になります(目次を見なくとも構造と繋がりがわかる程度まで)。
このアプローチの中で必要要素を付加していくことで、より堅牢なシステムへの積み上げが可能になります。(特に当日、グループCチームが担当していたISO 9001のみに含まれる項目がキーポイントになります)
規格は 一般財団法人 日本規格協会から購入が可能です。(9001はJIS版PDFであれば3,600円です)
9001は2015年度版になり日が浅いため様々な解説本などの情報がありますが、A4サイズ、PDFファイル内で用語検索が可能、などから、規格版の購入をおすすめしております。
規格を読み解き、自社システムへ自身で適応させていくプロセスそのものがISOの最も有効な活用手段です。
力量認定 基本-2、その他オンサイトトレーニングなどのご要望につきまして
実際のシステム監査を使い力量認定を行う基本-2、当日後方テーブルにありましたプレゼン資料、当日の基本-1編の再度組織内トレーニング、その他人的資源マネジメントに関連する各プログラムにつきまして、オンサイトトレーニングを提供しております。詳細は人的資源マネジメント以下、各リンクページをご覧ください。
また、ISO 22716立ち上げのご要望にもお応えしております。
https://www.kea-mgt.com/top-page/cns/iso22716/
詳細はGMP/QMSセミナー事務局までお問い合わせください。
ISO22716認証についての注意点(プライベート認証の確認)
2016-10-05 トピックス
KEA managemnetではISO 22716に関連した各種サポートを実施しております
認証取得検討の際は是非お問い合わせください。
現場運用と費用対効果に合わせたシステム構築、内部監査、教育訓練、委託先評価などのISO 22716に関するサポートを提供しております。関連記事はこちらから
ISO22716(化粧品GMP)の認証について
2007年に発行されたISO 22716は、日本化粧品工業会の自主基準に変わる新たな化粧品GMPとして運用が続けられております。従来は自主運用をベースに行われてきた活動ですが、近年はこのISO規格について認証を受ける企業/組織様も出てまいりました。私共にもISO22716認証に関して、どのように考えれば良いかのお問い合わせが増えてきております。
ISO22716の認証システムはISO 9001等の認証とは位置づけが全く異なります。お問い合わせの多くは、認証そのものの混同して捉えられている誤解からきているため本ページにまとめさせていただきました。
専門用語を少なくして出来る限り解りやすくまとめました。ISO22716取得を目指している企業/組織様へのご参考になれば幸いです。
ISOの認定/認証システムとは(特に品質マネジメントシステム関連領域)
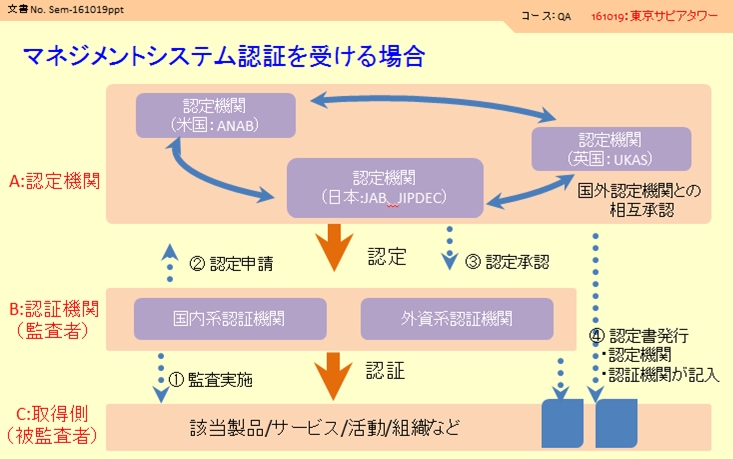
下記に認証システムの概略図を示します。認定/認証には異なる3つの組織が登場します。特に認定機関と認証機関を混同しないように注意してください。
A:認定機関(認定に責任を持つ組織です、各国に1つor2つあります)
B:認証機関(実際に監査に来る方が所属している組織です、国内系/外資系と多くの組織があります)
C:取得組織(自分の会社です)
実際の認証プロセスを追ってみましょう。
①:認証機関があなたの会社に監査に来ます。
②:監査結果は認証機関がまとめ→認定機関へ申請を行います。
(この申請部分は、あなたの会社側からは見えません)
③:問題がなければ認定機関により了承が行われます。
④:正式に認証され、適合マークが利用可能になります。
認証に関して表面上は①+④、B:認証機関、C:取得組織のやり取りで完了します。
実際は、A:認定機関から認定を受けたB:認証機関が代理で監査を行い、その結果を認定機関へ報告。A:認定機関が認定を発行するというプロセスになっています。これにより高い客観性と品質を保っています。
つまり、実際に監査に来る監査者は、認定機関から依頼を受けてあなたの会社に来ているとの位置づけです。
このため認証マークには「監査した機関」「認定を出した機関」の2つが並列して記載されます。
 マーク例は、
マーク例は、
認証機関(監査を実施した機関):JQA
認定機関(認定を出した機関):JAB
各国にある認定機関は、国際相互承認という形でその品質を担保しています。
ISO 22716認証プロセス
それではISO 22716認証とはどのようなステップで進むのでしょうか?
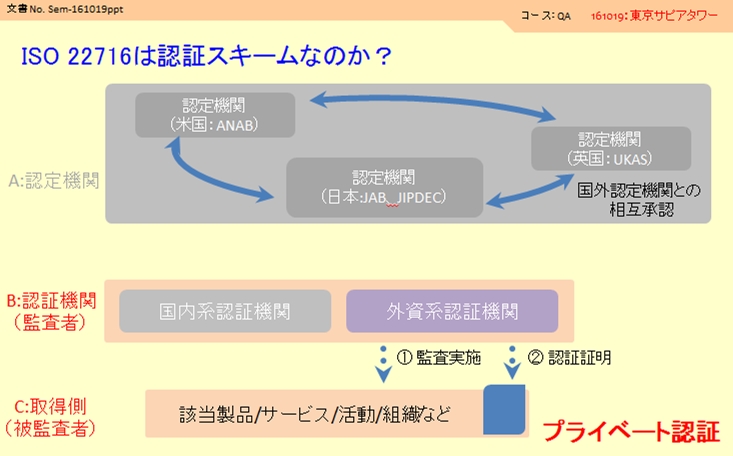
ここでは上記とは異なり2つの組織しか登場しません。
B:認証機関(実際に監査に来る方が所属している組織です、国内系/外資系と多くの組織があります)
C:取得組織(自分の会社です)
実際の認証プロセスを追ってみましょう。
①:認証機関があなたの会社に監査に来ます。
②:問題がなければ認証機関が自主的に承認して、認証発行を行います。
ISO 22716認証には国単位で登録されている認定機関の存在はなく、監査機関が自主的にOKを出す仕組みになっています。このような認証を「プライベート認証」といいます。
(品質マネジメントシステム時のような二段階の認証システムではないため、既に認証済みの企業様のマークを確認すると、認証機関のみの表示になっていることがお分かりになるかと思います)
認定機関を介さず自主的に認証を出すプロセスは、高い客観性が望まれる「第三者監査」に好ましくないと表現される場合があります。(自分で採点して、合格通知を出し、さらに対価として金額を請求できるため)
ISO 17021:適合性評価-マネジメントシステムの審査及び認証 を行う機関に対する要求事項では、監査者が依頼者との利害関係を持つことを禁止しています。
お問い合わせの中には、ISO 9001等の品質マネジメントシステム認証とISO22716認証を「同等」と誤解されている方がいらっしゃいます。プライベート認証は、あくまでも適合の自己宣言を補助する位置づけと考えると適切です。
ISO 22716認証を受けるために注意が必要な事
現在、ISO22716に関してプライベート認証を行っている機関がいくつかあります。
上記まとめの通り認定機関を介さない監査/認証システムのため、自社が目指すべき方向性…
「自社組織に対する22716認証の目的は何であるか」
「どのような活動プロセスを継続していくか」
「そのための自社内課題は」
などを事前に明確に設定することが必要です。
認証監査は規格との適合性のみを見て実行されるため、取得だけであれば比較的容易です。
(特に外資系の認証機関はJAB:日本適合性認定協会で禁止している予備監査を実施しており、先に答え合わせが出来てしまう)
「取得後に、自社にとってどのような価値ある活動へと変換していくか」
「それが具体的成果につながるか」
の点については、取得とは別軸で考えていかなければなりません。
認証がゴールではなく、その後の活動レビューで成果を共有していくことが目的地と認識することが適切であると考えます。
このため、証機関を選定する際は、目的地を具体的に共有/そのポイントを監査時に抽出/進捗を追うことが可能、等の要素を重点としてください。
ISO22716は2007年度版発行の古い規格になりました。現行のISO9001:2015は、文書体系構築と品質保証を主目的としていた旧版から、マネジメントシステムを主眼とした内容に変遷しています。特に上記のような課題設定について、トップマネジメントを含めた責任が明確に設定されています。
ISO 22716承認を目指す企業様において現在9001を運用されている場合、2015年度版の良点を組み込み活動推進することがポイントになると考えます。
キアマネジメントではISO 22716を元にした品質マネジメントシステム推進活動をサポートしております
化粧品GMPを基礎から学びたい、認証を検討しているが手の付け所が解らない
現システムの妥当性を確認したい、内部監査システムを強化したい、取引先の品質を担保したい
などのご要望にお応えいたします。詳細はメール/お問い合わせフォームよりご連絡下さい
ISO 9001:2015年度版適応を控えて-1
2016-09-28 トピックス
ISO 9001:2015年度版への適応について(主に医療機器、医薬部外品、化粧品、病院産業様)
QMS(品質マネジメントシステム)の規格として長年導入されているISO 9001は2015年版が9月15日に発行されましたた。移行期間は発行日より3ヶ年とされているため、ISO 9001:2008年度版を適応されている組織は、2018年9月14日までに新版への移行審査を受ける必要があります。
発行からちょうど一年が経過、私共の業務におきましてもISO 9001:2015年度版への適応のご質問やご相談が増えてまいりました。これは年一回のサーベランス監査の機会を2015年度版で適応する配慮からと考えます。
ISOというと書類を揃え、記録を取り、社内の承認印を積み重ねて…、というイメージを持たれる方が多いと考えます。
一側面においてこの認識は正しいのですが、煩雑な要素を多く含み、その活動自体が品質へどのように直結するか全員が視認することが難しいため、組織内部の推進力が落ち形骸化される事例を多く拝見してきました。認証維持のために、一部セクションの驚異的な努力をされる方々(主に品質管理関係の方)により、文書体系や記録が維持され、監査のタイミングに合わせて「乗り切る」という運用をされている組織も少なからず存在すると考えます。
現状でISO 9001:2008を運用されている組織は、次回更新監査時に2015年度版適応の調整が必要になります。この機会に自社のISO運用の意味、最大のメリットは何かを深く考えておきましょう。
そもそもISO 9001とは何なのか?(誕生の歴史と元々の目的)
誕生の歴史
ISO 9001の起源は1958年アメリカ国防総省の軍事向け品質規格であるMIL-Q-9858-Aに始まるといわれます。この規格は軍事同盟としてNATO軍用規格へ展開、イギリス、ドイツ、フランス等へ展開していきます。
各国でそれぞれ適応が進む中、このMIL-Q-9858-Aを母体とするアメリカの「米国工業規格ANZI Z1.15」、イギリスの「BS 5750」という二つの規格が合わさり、1987年にISO 9000シリーズが誕生します。
この9000シリーズは各国の品質保証規格として採用され、現在では9000(用語)、9001(品質マネジメントシステム)、9004(組織の持続的成功のための運営管理)として引き継がれています。
元々の目的とは…
誕生の歴史からも分かるようにISO 9000シリーズの根幹設計は軍事産業でした。軍需品はその使用用途から高度な品質が要求されます。アメリカ国防総省が兵器メーカーに軍需品発注を行う際、該当メーカーが要求する品質に答えられるかを監査形式で確認するために構築されたシステムです。
これらが時代と共に変遷し、製造業のみでなくサービス業の範囲でもでも良く見られる規格として定着してきました。
ISO 9001:2015年度版更新の前に…組織で考える
恐らくアメリカ国防総省から監査を受ける企業様はそれほど多くないでしょう。
それでは…
「なぜISO 9001運用しているのか?」
「一体何の目的で?」
2015年度版の改定ではトップマネジメントが担うべき範囲がより明確に記述されました。
ISO 9001運用に際し、先の2つの問に加え、「メリットは?」「デメリットは?」「どうして行きたいか?」など、一度深く考え、組織に伝達する必要があります。
次回は、このための思考材料となる「監査の種類と意味」についてまとめます。
セミナー情報:ISO22716対象 内部監査力量トレーニング講座 基礎-1
2016-09-20 セミナー関連
この先はGMP/QMS/ISO推進関連ご担当者様向け専用ページになっております。
専用コードをお持ちの方はご入力をお願いします。
コードをお持ちではなく先情報をご希望の方は、お問合せフォームより「パスワード発行依頼」のご連絡を頂けますようお願いします。自動返信メール後に改めましてパスコード発行メールを送信します。
(自動返信メールが届かない方は迷惑メール振り分けの確認、ドメイン@kea-mgt.com受信設定の確認後に再送をお願いします)
9/6環境微生物管理のバリデーションセミナーフォロー(リスクマネジメントのケース)
本日は残暑厳しい中、環境微生物管理に関するバリデーションのセミナーにご参加頂きありがとうございました。
セッション2「環境のバイオバーデン」項目内のケーススタディ回答案につきましてフォローアップいたします。
このケーススタディーは、環境微生物汚染の要素をMECE(モレなくムラなく)抽出することを目的として設定してあります。
キーポイントは日常の管理活動において、微生物汚染ファクターをどれだけ認識しているかです。
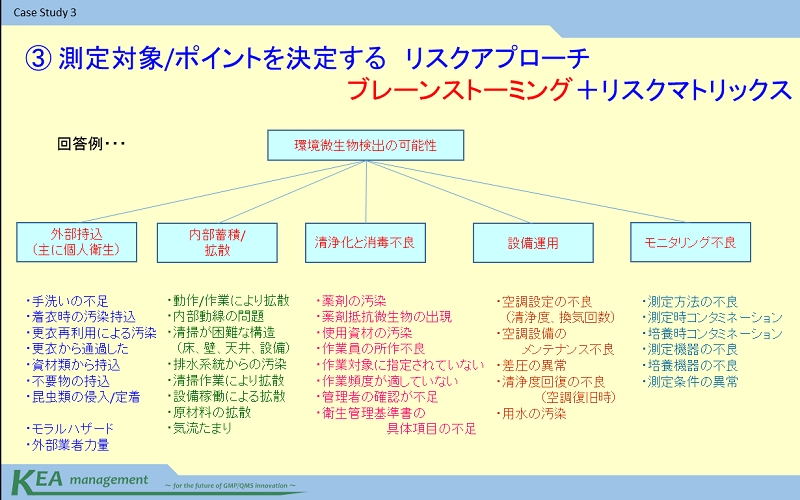
回答のモデルケースでは…
クリーンルーム環境の管理原則に関連する要素として
・外部持ち込み
・内部蓄積と拡散
直接的な環境微生物制御として
・清浄化及び消毒の不良
設備関連要素として
・施設設備運用
評価要素として
・モニタリング不良
の5項目に分類を行いました(ケースQ2回答)
各構成要素(ケースQ1)は上記PPTファイルをご参照ください。
これら要素の抽出分類の後、リスクアプロ―チ(今回はテキスト資料にございますリスクマトリックスを使用)を用いて各構成要素のポジションを作り、一定以上の枠を対象として環境バイオバーデンのポイントを設定していくことをご説明いたしました。
ICH Q9に収載される品質リスクマネジメントの資料は一定の参考になりますが、FMEA、FTA、HACCPなどの手法を使いこなすためには「事例と繋がりを抽出できる幅広い現場経験」と「手法を使いこなす慣れ」が必要になります。今回のセミナーでは各人思考によりケーススタディを進捗しましたが、実ケース想定して数人が集まりブレーンストーミング形式にて対応することが最も有用です。
今後、リスクマネジメントをより深く管理に取り入れていく場合、ISO 31010をぜび参照にしてください。
環境のバイオバーデン及び詳細な解析は、現状の管理状態の数値的な客観的評価、通常の微生物モニタリング仕様の妥当性を評価するうえでも重要なアプローチになります。設計時は基本の5ステップをトレースして、有用な管理へと結び付けて頂きたいと思います。
今回セミナーのご参加者様を対象にフォローアップの期間を設定しております。ご不明点、ご質問などがありましたら事務局までご連絡をくださりますようお願いいたします。

