年別アーカイブ: 2016年
ホームページを一部リニューアルしました
2016-12-26 トピックス
ご要望及び運用上の改善点を含めホームページを一部リニューアルしました。
・トップページからの提供商品へのリンクを一段浅く変更
・事業概要 代表者経歴一部追加
・一部ページの補完
・セミナー申し込み時の割引コード適応注意表記の追加
・2016年版に関するリンク情報のアップデート
情報の積算/データベースとして利用できるよう運営を継続いたします。
年末年始休業期間のお知らせ
2016-12-14 トピックス
2016年12月31日~2017年1月6日までは年末年始休業期間となります。
休業期間内に頂きましたお問合せ等につきましては2017年1月10日よりご連絡いたします。
どうぞ宜しくお願いいたします。
細菌分類同定の基本的アプローチ
2016-12-12 トピックス
製品、製造工程、製造環境における微生物モニタリングの結果は、培地上のコロニーとして認識が可能となります。しかしながら、検出された微生物のコロニーから引き出せる情報は極僅かであるため、通常はカウントによる「数」の記録、特徴的な「形態」や「色調」の記録に留まります。
バイオバーデンや原因不明時の微生物汚染発生時には、「分類」と「同定」を行いより深い考察をすることが必要になります。この分類と同定に関しては簡易的な識別手法から学名到達までの学術レベルの定義までがあるため、求める情報や適用できる試験系により適切な手法を選択しなければなりません。
お問い合わせを良く頂く項目ではありますが、各種ガイドラインでは体系的にまとめられている部分が少なく、自社内における基礎力量向上が難しい分野であるといえます。
分類と同定の基本アプローチ、基本試験項目についてまとめますのでご参考にしてください。
微生物管理の技術支援はこちらhttps://www.kea-mgt.com/top-page/mbc/
微生物の分類同定試験はこちらhttps://www.kea-mgt.com/top-page/mbc/taxonomy/
分類と同定の基本アプローチについて整理する
情報を集めることで分類を進めて行き、最終的に既知種基準株(Type Strain)との類似性を判定して初めて「同定」という結果に到達します。このため…
・このコロニーが○○菌であるか教えてください
・エリアA検出菌株と製品B検出菌株が同じ原因の微生物であるか判断したい
・同定試験の結果、この菌株がどのような条件で死滅するかの情報をください
などのアプロ―チと分類-同定試験から導き出される情報は必ず合致するわけではないとの前提を理解する必要があります。
「未知の菌株」→「いくつかの試験により情報を引き出す」→「既知種基準株と比較する」→「相同性があれば同定」となります。これはあくまでも既知種基準株との比較からの結論であるため、手持ち菌株の死滅条件や生育条件などの情報は別途個別に試験をして調べる必要があります。
高額な費用を使い検査会社に分析を依頼する事例を多く見受けますが、戻ってくる結果は…
菌株No.XXXは、○○○○と高い相同性を示しました。
菌株No.XXXは、○○○○と16S rRNA遺伝子の塩基配列領域において99.5%の相同性を示しました。
といった報告書であることが通常です。
微生物分類/同定の基本理解が不足している状態において、この結果から「実際の管理」や「問題解決への具体的アプローチを設計すること」は難易度の高いチャレンジであると言えましょう。
細菌分類同定の基本試験項目
「微生物分類」を行う上での基本的試験項目は比較的解りやすい項目に分けられます。自社製品や取引先製品に微生物管理の要求事項が関わる場合、品質管理/品質保証担当者は少なくともこれら項目についての理解を持つことが必要と考えます。
以下、細菌分野の分類同定の基本項目についてまとめます。
Ⅰ.表現型(Phenotype)
文字通り「うつつを表す」試験項目です。形や色、活性など多種多様な試験項目からのアプローチです。
-1.形態学的性質
細胞形態、グラム染色性、運動性(鞭毛)、胞子形成など
-2.生理・生化学的性質
Catalase、Oxidase、生育酸素条件、各種糖源の資化性など
製造プロセスや流通環境などの特定条件で生育するか、特定の滅菌条件で死滅するか等のも本項に含まれます
Ⅱ.遺伝型(Genotype)
対象菌株の遺伝情報から分類同定を行うアプローチです。
-1. G+C含量
四塩基中のグアニンとシトシンの占める割合を測定する古くからある手法です。
-2. DNA relatedness(DNA-DNA hybridization)
対象菌株と既知種基準株を用い、DNAの再会合率から種レベルの同定を行う手法です。
-3. 特定塩基配列のシークエンシング
16S rRNA領域など特定部分の塩基配列を読み取り、データベース照合を行うことで近縁種を検索する手法です
属範囲の決定、近縁性が高い場合は種レベル同定が可能です。
規格、ガイドライン等の記載
近年、各種ガイドラインや規格には微生物分類同定について具体的に適応を進める記述が増えています。
・日本薬局方17改正:G4微生物関連 遺伝子解析による微生物の迅速同定法
・ISO 11737-1:2006 医療機器の滅菌 -微生物学的方法- 製品上の微生物群の測定方法
「バイオバーデンの微生物学的特徴づけ」
・無菌操作法による無菌医薬品の製造に関する指針
微生物モニタリングプログラム(菌の同定あるいは性状検査を行う)
「何の情報を引き出すか」により試験項目が変化する
近年の技術進歩や価格競争により、比較的安価に微生物試験を自主実施及び外部委託できるようになりました。
製品や製造プロセス、製造環境などにおける微生物汚染発生は、製品品質に直結する早急な是正措置と共に再発防止や監視下におくためのより強固なモニタリングシステム構築など様々なアクションが必要になります。
画一的な分類同定試験に頼らず「何の情報を引き出すか」に意識を集め、具体的アクションへと繋がるため微生物管理を推進することが望まれます。
KEA managementでは各種微生物管理の技術支援、品質管理部門サポート、分類同定試験、微生物汚染発生時の原因究明サポートなどを提供しております。
2017年は分類同定の技術スクールを開催予定です。お問い合わせはフォームよりお願いいたします
医療機器/医療用具分野のバイオバーデンについて
2016-12-06 トピックス
バイオバーデン/微生物管理関連のオープンセミナーを定期開催しています、詳細はこちらから…。
医療機器QMS省令、ISO13485に関連して滅菌系若しくは微生物管理が要求される製品を取り扱う企業様の場合、定期的に確認が必要となるバイオバーデンという概念があります。
医療機器関連のバイオバーデンは「製品、及び/又は無菌バリアシステムの上又は内部に存在する生育可能な微生物群」として定義されます(ISO 11139:2006)。
一方で製薬分野では「滅菌前の原料及び資料等に製造する微生物の数と種類をいう」(無菌操作法による無菌医薬品の製造に関する指針から)などと定義され、若干のニュアンスの違いが認められます。
医療機器における定義はISOの和訳のため一見掴みづらい印象を持ちますが、意味合いを含め製薬分野の表現を含めて捉えることで少し身近に感じるかもしれません。
バイオバーデンは原材料、資料、最終製品などを対象として実施されます。これに加え、クリーンルーム内の製造環境に存在する微生物菌叢ともリンクを付け考察することで強固なバックデータを保持することが可能になります。
この「環境バイオバーデン」のアプローチは、影響を及ぼす因子を可能な限り抽出して、年間を通した振れ幅を把握を行った上で、原材料、資料、最終製品の菌叢とも相関を取ることが必要になります。
(詳細は環境微生物管理に関するバリデーションを参照 https://www.kea-mgt.com/archives/sem-160906/)
医療機器関連の企業様には微生物専門のセクションを設置しない場合も多く認められます。
一方で製造品目によっては「製品の滅菌性担保」「微生物汚染発生時の究明や考察」などの対応が必要になる場合が生じます。
今回は、医療機器関連の微生物管理の要求事項として「バイオバーデン」の関連情報をまとめてみたいと思います。
ISO 11737-1:2016医療用具の滅菌 微生物学的方法 (バイオバーデンについて)
ISO 11737-1で定義される規格は、JIS T11737-1:2103と相互リンクしており「医療機器、構成部品、原料又は包装上若しくはその内部における生育可能な微生物群の計測および特性付けのための要求事項」と概要説明がついている。
主な要求事項は4項~8項まで。
4項:品質マネジメントシステムに関連する要素
・文書化
・経営者の責任
・製品実現
・不適合製品の管理
が含まれます。
ISO 9001を踏襲した前提条件の位置づけになりますが、バイオバーデンそのものが経営者の責任範囲に含まれ、責任や権限を予め定めることが要求事項になっています。また、文書化の一部には、記録の取扱い内に計算やデータ変換のチェックシステムが含まれることも、9001や13485には出てこないユニークな要求項目です。
5項:製品の選択
・一般
・分割試料
が含まれます。
この項では、選択したサンプルが製造プロセス内の代表であることを根拠を持って説明できることが要求事項になっています。またサンプリングから試験までの時間設定も含まれます。
製品形態として試験をする場合は、想定される汚染がスポット的であるか、全域に渡っているかで部位設定を行わなければなりません。
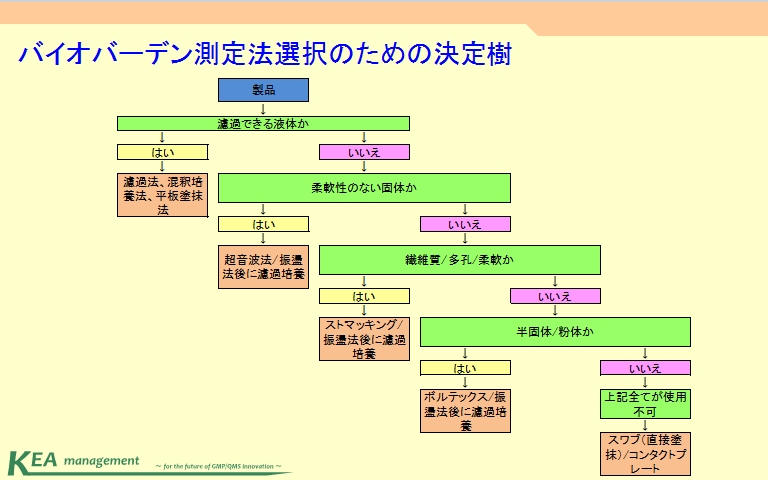
6項:バイオバーデンの測定及び微生物的特徴づけの方法
・バイオバーデンの測定
→手法選択
→微生物の取り出し
→微生物の培養
→菌数測定
・バイオバーデンの微生物学的特徴づけ(分類同定)
が含まれます。
バイオバーデンを測定するにあたり一番メインとなる項になります。特に測定部では設計と選択手法の妥当性について裏を取ることが要求事項になります。取り出し方法については決定樹を参考にして決めると良いでしょう。
7項:測定方法のバリデーション
・試験方法はバリデートし文書化する
・微生物を取り出す方法の妥当性評価
・補正回数のため回収率設定
・菌数測定の妥当性評価
・分類同定の技術の妥当性評価
が含まれます。
7項では試験系のバリデーションが要求事項として定義され、文書化までが求められます。取り出し方法の妥当性や補正率回収率の設定については、重要な項目になりますので設計段階から組み込むことが必要です。
8項:日常のバイオバーデン測定及びデータの解釈
・サンプルサイズ+頻度を決めたサンプリング計画の文書化
・あらかじめ定めた方法でバイオバーデンの実施
・通常と異なる菌叢の微生物検出時は分離菌株の特性評価を考慮
・滅菌プロセス確立との関連性
・データに基づく許容限界値と逸脱時の処理方法の設定
・一定期間ごとのバイオバーデンデータの傾向分析と許容限界値のレビュー/改定
が含まれます。
初期のバイオバーデン試験の詳細データが不明確な場合、この8項に沿って実施されている事例を多く見受けられます。要求事項では6項、7項をベースとして8項が立案される位置づけです。これにより日常のバイオバーデンそのものがバリデーションされる構造になっています。
現状でサイズやサイクルの根拠が不明確、異常時であるかを検出/確認するための仕組みが決められていない、等の場合は、前項まで戻り設計を強固にしてください。
9項:バイオバーデン測定方法維持
・製品及び製造プロセスの変更時、バイオバーデン変化の可能性をレビュー/記録
・測定方法の変更がある場合、測定結果に与える影響、回収率の面から評価
・初期/再バリデーションのレビューについて定期実施期間を定めて文書化
・再バリデーション結果の記録
が含まれます。
ここでは、日常のバイオバーデン測定が連続的に安定してデータになるための事項が含まれます。。特に再バリデーションの仕組みをシステムとして文書に組み込むことが要求されているため注意が必要です。つまり、初期のバイオバーデン一式のデータをそのまま継続的に適応することが好ましくなく、何らかのタイミングにより定期的な再バリデーションを掛け記録を残すことが必要とされます。
以上、医療機器関連のバイオバーデンの要求事項についてまとめてきました。
2社監査、更新監査時などにこの分野に詳しいオーディターが含まれる場合、指摘や確認を受けることがあります。バイオバーデン試験プロセス自体が様々なバリデーション項目とリンクしています。現手技手法やデータについて根拠ある説明ができない場合は上記要求事項を見直し、堅牢なシステムへと構築することが必要です。
また、バイオバーデン試験及び考察は製品の微生物汚染発生を未然に防ぐことのできる数少ない打ち手です。特に自社資源では対応が難しい専門項目も含まれるため「微生物汚染などの問題が発生」してからの対応ではなく、他のバリデーション項目と足並みをそろえた推進が望まれます。
微生物汚染の原因究明、微生物管理/バイオバーデン試験のお問合せはフォームからお願いいたします